- 07/07
- 2025
-
QQ扫一扫

-
Vision小助手
(CMVU)
血清素(5-羟色胺,5HT)作为关键神经递质,其水平异常与抑郁症、焦虑症等神经系统疾病密切相关。传统检测方法面临灵敏度低、选择性差的挑战,而单壁碳纳米管(SWCNT)因近红外(NIR-II,1000-1700 nm)荧光特性,穿透深度高且背景干扰低,成为生物传感器的理想材料。单链DNA(ssDNA)包裹的SWCNT(ssDNA-SWCNT)可通过荧光变化响应目标分子,但天然序列的传感性能需优化。
一、核心技术框架
1.1 定向进化原理
模拟自然选择过程,对ssDNA序列进行人工突变与筛选,目标是获得对5HT响应更优的ssDNA-SWCNT复合物。该方法突破传统蛋白质工程局限,首次应用于核酸-纳米材料复合体系。
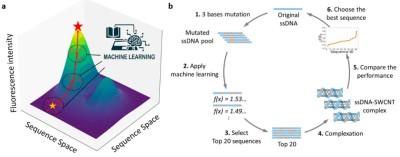
图1:(a) 借助机器学习模型的定向进化。在定向进化过程中应用机器学习模型,以预测可能展现出更优传感器响应的序列。(b) 基于机器学习筛选的血清素(5 - 羟色胺,5HT)响应型单链 DNA - 单壁碳纳米管(ssDNA-SWCNT)纳米传感器定向进化方案。
1.3 高通量筛选逻辑
每轮突变产生22,032种序列,ML模型预测后选取top 20序列实验验证,替代传统全样本测试,将筛选效率提升超1000倍。
二、分阶段优化
2.1 第一阶段:灵敏度优化(3轮定向进化)
第1轮:初始序列与突变设计
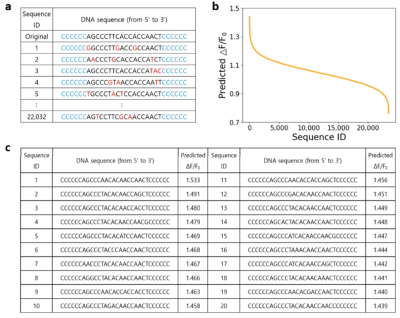
图2:用于定向进化的单链 DNA(ssDNA)序列及预测得分:(a)原始序列的 3 碱基突变序列示例。每轮通过机器学习模型测试 22,032 条突变序列,突变碱基以红色高亮显示。(b)第一轮中所有 22,032 条突变序列的机器学习模型预测 ΔF/F₀均值图(按降序排列)。ΔF/F₀定义为添加 5HT 后荧光强度的增加比例。(c)机器学习模型预测 ΔF/F₀蕞高的前 20 条序列。
起始序列:选用前期研究中对5HT有响应的30-mer ssDNA(5′-CCCCCCAGCCCTTCACCACCAACTCCCCCC-3′)。突变策略:对中心18个碱基进行3碱基随机突变(两侧各保留6个连续C碱基),生成22,032种突变序列。ML筛选:通过集成模型预测ΔF/F₀,选取top 20序列合成,实验验证后最佳序列为N1-12,ΔF/F₀达2.366(原始序列0.949),提升2.5倍。
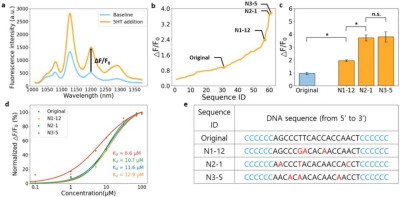
图3. 针对灵敏度的三轮定向进化。(a) 原始序列 ssDNA-SWCNT 复合物溶液在添加和未添加 5HT 时的荧光光谱。ΔF/F₀由 1202 nm 处的荧光强度计算得出,并用作灵敏度的衡量标准。(b) 测试序列的实验 ΔF/F₀值图。N1-12、N2-1 和 N3-5 分别标记了第 1、2 和 3 轮中的最佳性能值。请注意,最佳性能 ΔF/F₀值随着轮次的增加而增加。(c) 每轮中最佳性能序列和原始序列的 ΔF/F₀值。* 表示 p < 0.05 时的统计显著结果,n.s. 表示 p > 0.05 时的非统计显著结果。当 N3-5 与 N2-1 进行 t 检验时无统计学意义,因此进化在第 2 轮时已饱和。(d) 标准化 ΔF/F₀作为 5HT 浓度函数的校准曲线。每条校准曲线分别代表原始(蓝色)、N1-12(橙色)、N2-1(绿色)和 N3-5(红色)序列的 ssDNA-SWCNT。每个浓度(0.1 至 100 μM)的实验均重复三次。(e) 灵敏度实验中每轮的蕞佳性能序列。
第2轮:以N1-12为模板迭代
突变库规模同上,ML预测后实验验证,蕞佳序列N2-1的ΔF/F₀提升至3.705,解离常数(Kd)从原始序列的11.6 μM降至10.7 μM。
第3轮:饱和优化
以N2-1为模板,筛选出N3-5序列,ΔF/F₀达3.765,但与N2-1无统计学差异,表明灵敏度优化进入平台期。
2.2 第二阶段:选择性优化(2轮定向进化)
挑战:结构相似性干扰
5HT与多巴胺(DA)结构相似,传统传感器存在交叉响应,需以5HT/DA荧光响应比(5HT/DA = ΔF₅HT/F₀ ÷ ΔF_DA/F₀)为指标优化。
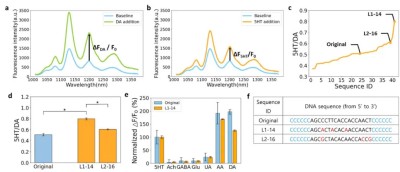
图 4. 针对选择性的两轮定向进化。(a) 原始序列 ssDNA-SWCNT 复合物溶液在添加和未添加多巴胺(DA)时的荧光光谱。(b) 原始序列 ssDNA-SWCNT 复合物溶液在添加和未添加 5HT 时的荧光光谱。(c) 按升序排列的全序列选择性值图。选择性通过 5HT 与 DA 的 ΔF/F₀比值(5HT/DA)计算,即 (ΔF₅HT/F₀)/(ΔF_DA/F₀)。L1-14 和 L2-16 分别表示第一轮和第二轮的最佳性能值,可见第二轮性能较第一轮降低。(d) 每轮蕞佳性能序列与原始序列的 5HT/DA 值。* 表示 p<0.05 时的统计显著结果,n.s. 表示 p>0.05 时的非统计显著结果。L2-16 与 L1-14 进行 t 检验时具有统计学意义,但因性能低于 L1-14,表明选择性优化在第一轮已达饱和。(e) 针对 100 μM 5HT 的 ΔF/F₀,测试 100 μM 乙酰胆碱(Ach)、γ- 氨基丁酸(GABA)、谷氨酸(Glu)、抗坏血酸(AA)和 10 μM 尿酸(UA)的 ΔF/F₀值。实验采用原始序列和 L1-14 序列,每种分析物重复三次。(f) 选择性实验中每轮的蕞佳性能序列。
第1轮:初始选择性筛选
以原始序列为模板突变,ML模型同时预测5HT和DA的ΔF/F₀,计算5HT/DA比值。蕞佳序列L1-14的5HT/DA比为0.799,较原始序列(0.508)提升1.6倍。
第2轮:L1-14模板迭代
筛选出N2-6序列,5HT/DA比0.592,但性能低于L1-14,表明选择性优化在第1轮已接近饱和。
2.3 实验验证体系
ssDNA-SWCNT复合物制备
1.0 mg ssDNA与1.0 mg SWCNT混合于1×PBS,浴超声3分钟后,冰浴探头超声20分钟(50%振幅)。21,000×g离心1小时,取上清稀释100倍,通过632 nm吸光度计算浓度(消光系数0.036 mg·L⁻¹·cm⁻¹)。
荧光响应检测
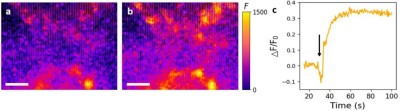
图5. N2-1传感器的荧光图像及荧光随时间变化分析。(a,b)玻璃盖玻片表面固定的N2-1传感器在5HT处理前后的荧光图像(比例尺:10微米)。(c)多个传感器区域的荧光强度随时间变化曲线,箭头所示为注射5HT的时间点。(荧光图像由英国 Raptor Photonics 公司的NINOX 640 相机,通过 950 nm 长通滤光片采集。)
灵敏度测试:在1195 nm监测5HT(0.1-100 μM)诱导的ΔF/F₀变化。选择性测试:在1202 nm对比5HT、DA、乙酰胆碱等分子的荧光响应,计算5HT/DA比值。
2.4 表面固定化功能验证
APTES修饰玻璃基底吸附SWCNT,成像腔中加入100 μM 5HT,NINOX 640相机通过950 nm长通滤镜记录荧光变化,1分钟内ΔF/F₀提升40%。
三、研究结果
灵敏度突破:3轮优化后,N2-1序列的ΔF/F₀达3.705(原始0.949),Kd降至6.6 μM,结合力显著增强。选择性提升:L1-14序列的5HT/DA比达0.799(原始0.508),对其他神经递质(如GABA、乙酰胆碱)几乎无响应。实际应用潜力:表面固定化传感器在5HT刺激下荧光稳定增强,为神经细胞原位监测提供可行性。
四、研究意义
方法学创新:首次将ML集成到ssDNA-SWCNT定向进化中,建立“预测-筛选-验证”的高通量开发范式,相比传统随机筛选效率提升超1000倍。材料设计启示:发现A碱基突变在灵敏度(N2-1)和选择性(L1-14)优化中的关键作用,为后续序列工程提供理论依据。临床转化价值:近红外荧光特性适配生物组织深层成像,高灵敏/选择性传感器可用于帕金森病、抑郁症等疾病的血清素动态监测。
(文章来源于星光光技术,如有侵权,请联系删文)
